Молекулярные орбитали
*
Молекулярные орбитали
 Как известно почти любому первокласснику, атом состоит из ядра и электронов, вращающихся вокруг ядра. Если два атома подходят друг к другу близко, орбитали их электронов начинают перекрываться. Поскольку электрон - квантовый объект, то у него имеются волновые свойства. А две перекрывающиеся волны начинают интерферировать. Интерференция - это явление наложения волн друг на друга, которое приводит к тому, что в одних точках волны, возникшие в результате интерференции, становятся сильнее, чем были у каждой волны по отдельности, а в
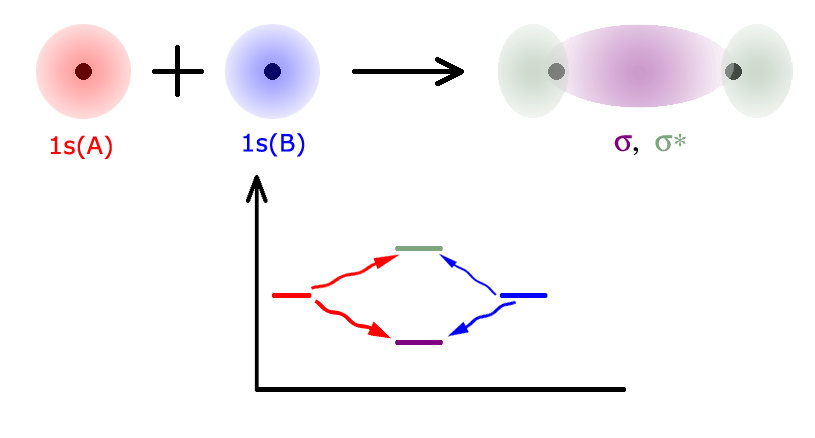
Как известно почти любому первокласснику, атом состоит из ядра и электронов, вращающихся вокруг ядра. Если два атома подходят друг к другу близко, орбитали их электронов начинают перекрываться. Поскольку электрон - квантовый объект, то у него имеются волновые свойства. А две перекрывающиеся волны начинают интерферировать. Интерференция - это явление наложения волн друг на друга, которое приводит к тому, что в одних точках волны, возникшие в результате интерференции, становятся сильнее, чем были у каждой волны по отдельности, а в других - слабее, чем у каждой волны по отдельности. На рисунке слева показана интерференция волн, распространяющихся по луже воды в результате падения нескольких капель. В некоторых местах результат интерференции хорошо заметен безо всяких приборов. Например, в точке, отмеченной красной стрелкой, минимум (нижняя точка колебания) одной волны наложился на минимум другой. В результате в этой точке образовался заметно более глубокий минимум. Интерференция различных волн может создавать самые причудливые картины. Характерной особенностью этих картин всегда является чередование "светлых" и "темных" участков, то есть участков, в которых амплитуда колебания велика, и участков, в которых она мала. Так вот, при перекрывании орбиталей электронов двух сблизившихся атомов электронные волны тоже интерферируют. И при этом вместо двух атомных орбиталей образуются совершенно другие, молекулярные орбитали. Энергия и форма молекулярных орбиталей резко отличается от атомных. Если две атомные орбитали могли быть одинаковыми (если взаимодействуют два одинаковых атома, например, два атома водорода: Н + Н → Н2), то образовавшиеся орбитали будут различными: одна в результате положительной интерференции будет иметь более высокую энергию, чем любая из прежде существовавших атомных орбиталей, другая - более низкую в результате отрицательной интерференции. Для образования молекулы водорода из двух атомов можно изобразить изменение формы и энергии орбиталей в виде следующей схемы:
других - слабее, чем у каждой волны по отдельности. На рисунке слева показана интерференция волн, распространяющихся по луже воды в результате падения нескольких капель. В некоторых местах результат интерференции хорошо заметен безо всяких приборов. Например, в точке, отмеченной красной стрелкой, минимум (нижняя точка колебания) одной волны наложился на минимум другой. В результате в этой точке образовался заметно более глубокий минимум. Интерференция различных волн может создавать самые причудливые картины. Характерной особенностью этих картин всегда является чередование "светлых" и "темных" участков, то есть участков, в которых амплитуда колебания велика, и участков, в которых она мала. Так вот, при перекрывании орбиталей электронов двух сблизившихся атомов электронные волны тоже интерферируют. И при этом вместо двух атомных орбиталей образуются совершенно другие, молекулярные орбитали. Энергия и форма молекулярных орбиталей резко отличается от атомных. Если две атомные орбитали могли быть одинаковыми (если взаимодействуют два одинаковых атома, например, два атома водорода: Н + Н → Н2), то образовавшиеся орбитали будут различными: одна в результате положительной интерференции будет иметь более высокую энергию, чем любая из прежде существовавших атомных орбиталей, другая - более низкую в результате отрицательной интерференции. Для образования молекулы водорода из двух атомов можно изобразить изменение формы и энергии орбиталей в виде следующей схемы:
Стоит обратить внимание на несколько нюансов:
1. Число орбиталей не меняется: в двух атомах водорода было по одной атомной орбитали (1s-орбиталь атом A, которую я для удобства обозначил красным цветом, и 1s-орбиталь атома В, обозначенная синим), вместе - две орбитали), стало две орбитали.
2. До взаимодействия атомные орбитали были совершенно одинаковыми по форме и по энергии (красный и синий цвет не обозначают различия между ними - просто иначе мы запутаемся в рисунке). После взаимодействия две молекулярные орбитали (σ и σ*) отличаются и друг от друга, и от своих "прародительниц".
3. Орбиталь σ* (серо-зеленого цвета) состоит из двух половинок, не соединенных друг с другом. Это не должно удивлять, потому что мы говорим о волнах. Волна не обязана быть непрерывной, в некоторых местах ее амплитуда вполне может быть нулевой, в частности, в результате интерференции.
Атом и молекула водорода представляют собой очень простой случай изменения орбиталей, потому что в атоме водорода лишь один электрон, который находится в нормальном состоянии на одной простой сферической 1s-орбитали. Ситуация становится существенно менее простой, если речь идет об образовании молекулярных орбиталей из немного более сложных атомов. Рассмотрим, например образование молекулы кислорода. В невозбужденном атоме кислорода электроны находятся на пяти орбиталях: 1s, 2s, 2px, 2py и 2pz:
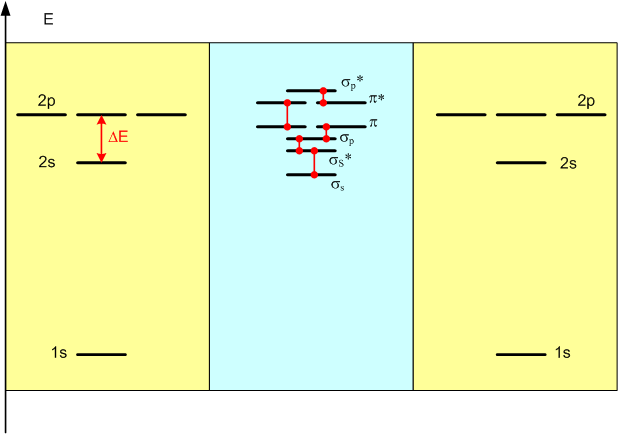
Поскольку все эти орбитали сосредоточены вокруг одного и того же центра, то показать их на одном рисунке (странное "сооружение" в правой части картинки) - задача не из простых: даже если "выкрасить" каждую орбиталь разными цветами, и сделать их прозрачными, все равно очень сложно что-либо понять. Понятно, что при взаимодействии двух атомов кислорода и образовании из атомных орбиталей молекулярных орбиталей картина станет еще сложнее. На практике применяются два способа обойти это затруднение: либо каждую орбиталь изображают по отдельности, либо их вообще не рисуют, а представляют в виде графиков, например, диаграмм энергии. Посмотрите, как выглядят диаграммы энергии образования молекулярных орбиталей кислорода (О2):
На желтых полях диаграммы показаны атомные орбитали двух атомов кислорода до того, как эти атомы начинают взаимодействовать. Поскольку мы говорим о двух атомах одного и того же элемента, между орбиталями левого желтого поля и правого желтого поля нет никакой разницы. Самую низкую энергию имеет орбиталь первого энергетического уровня 1s - маленькая сферическая орбиталь, показанная на предыдущем рисунке розовым кружком. Затем, намного выше по оси энергии, идет группа из четырех орбиталей второго уровня (2s и 2px, 2py, 2pz, которые обозначены на диаграмме тремя "полочками" 2p на одинаковой высоте). Второй уровень расщеплен на два подуровня: немного ниже по энергии находится подуровень 2s, а немного выше - 2p. Разница энергии между двумя этими подуровнями обозначена ΔЕ на левом желтом поле.
Когда два атома кислорода сближаются в пространстве на достаточное расстояние, их внешние орбитали (второго уровня) частично перекрываются и начинают активно интерферировать. Орбитали первого уровня, спрятанные внутри атома, не затронуты этим процессом, поскольку атомы не способны сблизиться на такое маленькое расстояние, чтобы началось перекрывание внутренних орбиталей. Поэтому на голубом поле диаграммы, где показаны молекулярные орбитали, атомным орбиталям 1s не соответствует ничего - эти орбитали не меняются и не участвуют в образовании молекулы. Зато с атомными орбиталями второго уровня происходят очень большие изменения. Их число остается тем же (восемь орбиталей: одна 2s и три 2p с каждого атома), но энергия и форма в результате интерференции изменяется кардинально. В результате после образования молекулы мы видим совершенно другие, молекулярные орбитали: σs, σs*, σp, π, π* и σp*. Очень существенным и важным в последующем обсуждении моментом является то, что если прежде (до образования молекулы) второй уровень был расщеплен на два подуровня, то теперь молекулярные орбитали расщеплены аж на шесть подуровней! Разность энергии между разными подуровнями молекулярных орбиталей различна, но она всегда меньше ΔЕ. Этот момент чрезвычайно важен по той причине, что очень многие химические и физические процессы (например, наличие цвета у вещества) связаны с переходом электронов с одного подуровня на другой, а вероятность и легкость такого перехода зависят от разности энергии. Пока что мы можем констатировать, что переход электронов между подуровнями молекулярных орбиталей существенно легче, чем между подуровнями атомных.
- Subscribe
- Блог пользователя lugovsa
- Войдите, чтобы оставлять комментарии
Новые записи в блогах
- Как добиться популярности в TikTok
- Как производятся памятники из гранита
- Фильм «Джон Картер» - жизнь на Марсе есть
- Театр-Музей Сальвадора Дали и замок Пуболь
- Игровой автомат Golden Games в казино Эльдорадо
- SlotV с небывалой отдачей
- Шоп туры в Италию
- Пляжный отдых в Греции и Испании
- Заработок без вложений - как поднять денег на играх.
- ТОП достопримечательностей Берлина


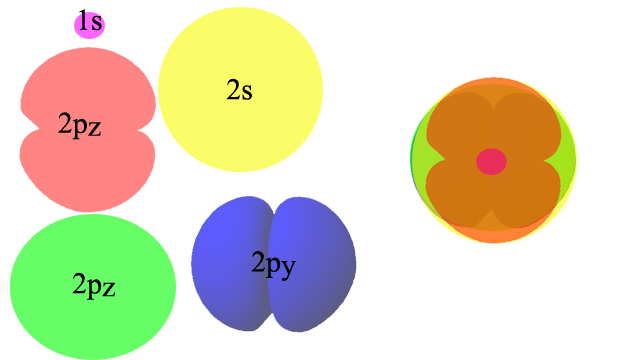

Новые комментарии