Мойте руки перед едой, или прикладная нанотехнология
*
В далекие времена, когда я учился на химфаке советского университета, слово "нанометр" произносилось безо всякого такого особого придыхания и пиетета, а было не более, чем обычным техническим термином, применяемым, например, для измерения длин волн видимого света. И в те далекие времена одним из предметов в программе обучения химии был курс "Коллоидная химия". Времена сменились, приставка "нано-" обрела весомость и важность, и однажды я не без удивления обнаружил, что наноматериалы и те вещества, которые изучает коллоидная химия, являются, вообще-то, одним и тем же. Правда, справедливости ради, следует отметить, что нанотехнология смотрит на эти вещества совсем под другим углом и поэтому не стоит видеть в ней старую добрую коллоидную химию. Ведь, в конце концов, тот факт, что строение и состав земной коры интересует и физиков, и геологов, и химиков не является основанием для объединения этих трех дисциплин в одну. И тем не менее, нанотехнология широко использует ассортимент средств и методов коллоидной химии, поэтому нам будет сложно продвигаться дальше, не обсудив кое-что "из жизни коллоидов".
Прежде чем я закончу введение в тему коллоидной химии, я хочу объяснить, почему эта часть названа "Мойте руки перед едой, или прикладная нанотехнология". А заодно и продемонстрировать сходства и различия между коллоидной химией и нанотехнологией. Итак, о мытье рук (не обязательно перед едой).
Механизм действия мыла сводится, в основном, к следующему: Очень грубо, загрязнения на коже или на ткани можно разделить на две группы. Во-первых, это - вещества, которые растворяются в воде. Во-вторых, вещества, которые не растворяются в воде, но зато растворяются в жирах. Теоретически, любое вещество должно растворяться либо в воде, либо в жирах, потому что вода является одним из самых сильнодействующих полярных растворителей, жиры, масла или бензин - неполярные растворители, а одно из правил химии в отношении растворения гласит, что подобное растворяется в подобном. Соответственно, если вещество полярно, оно должно растворяться в воде, а если неполярно - в бензине, масле или жире. А если некоторые вещества позволяют себе не считаться с эти правилом и не растворяются ни в том, ни в другом, то это - их личная проблема редкое исключение, которым для начала можно пренебречь.
Так вот, когда мы моем руки, то водорастворимые вещества на коже легко смываются. Те, которые не смываются, требуют неполярных растворителей. И вот тогда-то в дело вступает мыло. Молекула типичного мыла, например, стеарата натрия, который является основным компонентом хозяйственного мыла, устроена следующим образом:
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-COONa
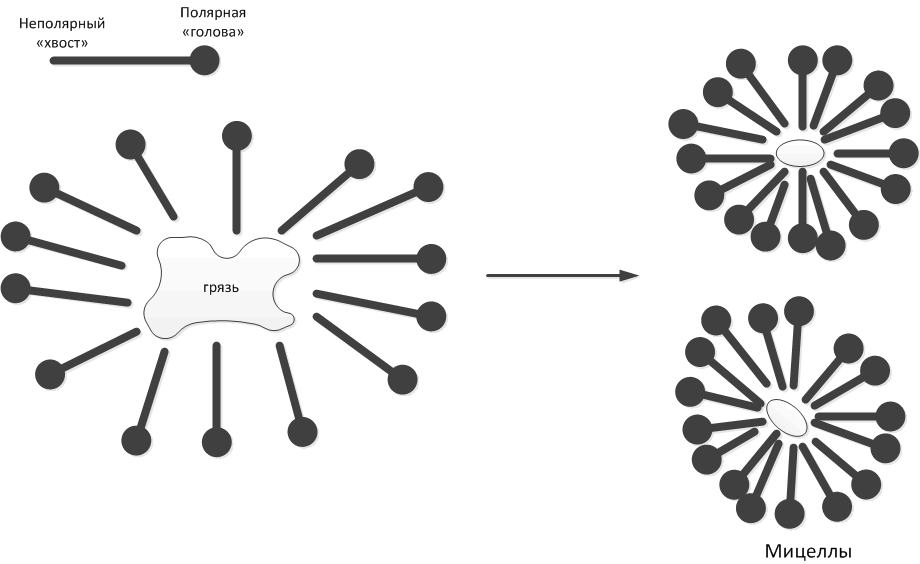
Длиннющий "хвост" из групп CH3- и CH2- неполярен, зато группа -COONa полярна. Поэтому молекула мыла является амбиполярной (имеющей двойную полярность, и полярной, и неполярной одновременно). Такие молекулы прекрасно контактируют и с водой, и с жирами, служа своеобразным посредником между ними. Когда мы добавляем мыло в воду, молекулы мыла начинают притягиваться к частичке жирорастворимой грязи своими неполярными "хвостами", оставляя полярные "головы" в водной фазе. В результате грязь становится растворимой в воде - при посредстве молекул мыла. И удаляется. Схематически это можно изобразить вот так:
Получившиеся в результате частички грязи, окруженные со всех сторон молекулами мыла, называются мицеллами. Обычно мицеллы имеют размеры 10 - 200 нм (и поэтому безусловно входят в число нанообъектов). Коллоидная химия интересуется их образованием, строением, поведением. А нанотехнология интересуется тем, как стабилизировать такие объекты и из них, или при их помощи, получить устойчивые наноструктуры.
- Subscribe
- Блог пользователя lugovsa
- Войдите, чтобы оставлять комментарии
Новые записи в блогах
- Как добиться популярности в TikTok
- Как производятся памятники из гранита
- Фильм «Джон Картер» - жизнь на Марсе есть
- Театр-Музей Сальвадора Дали и замок Пуболь
- Игровой автомат Golden Games в казино Эльдорадо
- SlotV с небывалой отдачей
- Шоп туры в Италию
- Пляжный отдых в Греции и Испании
- Заработок без вложений - как поднять денег на играх.
- ТОП достопримечательностей Берлина



Новые комментарии