Физические размышления перед налитым стаканом
*
Вы любите газированные напитки? Одни любят, другие - не очень. С моей сугубо личной точки зрения это странно - сначала покупать газированную воду или шампанское, а потом вкладывать немало труда и сил, чтобы удалить из них купленный вместе с напитком газ. Намного проще было бы купить воду без газа или негазированное Шардоне. Впрочем, у разных людей разные странности. Впрочем, я не об этом. Я предлагаю вспомнить или (для любителей поэкспериментировать) произвести несколько очень простых экспериментов с газированными напитками. Совершенно неважно, каким именно будет напиток - кола-кола, шампанское или обычная газвода ведут себя практически одинаково. Разумеется, после проведения эксперимента его необходимо объяснить.
Эксперимент 1: Открываем бутылку и оказываемся все в пене
Берем бутылку, например, кока-колы. Лучше пластиковую - в ней легче контролировать процесс. Аккуратно ставим бутылку на стол. Напиток спокоен, пузырьков газа не видно. Не торопясь, начинаем открывать. Крышка еще не открылась до конца, а мы уже все в пене, которая мгновенно образуется в бутылке в огромном количестве. Почему?
Объяснение этому явлению несложно и широко известно. В бутылке находится раствор, который содержит очень высокую концентрацию углекислого газа. Под "очень высокой" следует понимать концентрацию, близкую или даже превышающую тот максимум, который можно растворить в данных условиях. Количественно эта концентрация может казаться достаточно небольшой. Например, в одном литре воды при нормальных условиях можно растворить примерно 1.5 мг гелия, порядка 2.5 мг азота или аж 530 граммов аммиака. Поэтому 100 граммов аммиака в литре воды - это менее высокая концентрация, чем 1 мг гелия в литре воды. Если концентрация газа (в данном случае речь идет об углекислом газе, растворимость которого при нормальных условиях примерно 1.5 грамма на литр воды) равна предельной, раствор называется насыщенной. В определенных случаях концентрация газа превышает предельную, тогда раствор будет пересыщенным. Пересыщенный раствор - классический случай метастабильного состояния: термодинамически он невозможен, но кинетически система не может выйти из локального минимума энергии из-за потенциальных барьеров.
В закрытой бутылке над слоем жидкости был газ под довольно приличным давлением. И именно это давление не давало образоваться пузырькам. При образовании в жидкости пузырька объем жидкости вместе с пузырьком немного возрастает (поскольку пузырек, даже самый маленький, занимает некоторое место). Значит, жидкость с пузырьками стремится расшириться. Но этому как раз и препятствует избыточное давление газа над жидкостью. Газ, как будто невидимый поршень давит на жидкость и не дает ей расшириться. В результате процесс образования пузырьков требует вложения большой энергии для преодоления сопротивления газа. В обычном состоянии у системы просто нет достаточного количества свободной энергии.
А как можно "помочь" системе? Двумя способами. Во-первых, можно поднять энергию жидкости, например, нагрев ее. (Я вас умоляю, не надо бросаться греть бутылку с газированным напитком! Если все получится - а оно получится, то в лучшем случае вам придется потом долго убирать последствия, а в худшем это может представлять реальную опасность, особенно если бутылка стеклянная.) На практике этим спсобом пользуются редко, потому что (к счастью) газированные напитки принято пить охлажденными.
Во-вторых, можно понизить давление газа над жидкостью. Вот это-то и происходит, когда вы открываете крышку. Часть газа выходит из бутылки, а оставшийся оказывается не в силах удержать процесс образования пузырьков. Объем вспенившейся жидкости резко возрастает и вы рискуете оказаться облитыми.
Эксперимент 2: Опускаем соломинку (или палец) в стакан с напитком
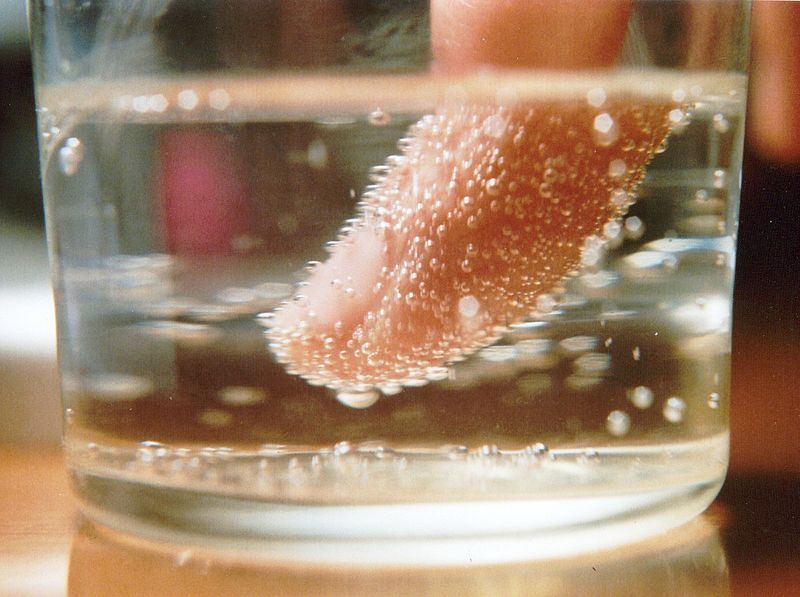 После того как мы сумели, не облившись пеной, открыть бутылку с газированным напитком, нальем немного в стакан. Первые несколько секунд в стакане есть пена. Это понятно - процесс выделения газа из-за падения давления в бутылке еще не закончился. Но через некоторое время пена исчезнет, и в стакане будет вполне прозрачная жидкость. Можно дать ей постоять несколько минут (для газированной воды меньше, для шампанского - больше), и пузырьки полностью исчезнут. И вот в этот момент внесем в жидкость какой-нибудь посторонний предмет - соломинку для питья или палец, как показано на картинке. Практически сразу мы увидим, как пузырьки начинают образовываться снова. Причем основная их часть образуется на том постороннем предмете, который мы внесли в стакан. Почему?
После того как мы сумели, не облившись пеной, открыть бутылку с газированным напитком, нальем немного в стакан. Первые несколько секунд в стакане есть пена. Это понятно - процесс выделения газа из-за падения давления в бутылке еще не закончился. Но через некоторое время пена исчезнет, и в стакане будет вполне прозрачная жидкость. Можно дать ей постоять несколько минут (для газированной воды меньше, для шампанского - больше), и пузырьки полностью исчезнут. И вот в этот момент внесем в жидкость какой-нибудь посторонний предмет - соломинку для питья или палец, как показано на картинке. Практически сразу мы увидим, как пузырьки начинают образовываться снова. Причем основная их часть образуется на том постороннем предмете, который мы внесли в стакан. Почему?
Очевидно, на этот раз дело не в температуре и не в давлении. Температура соломинки может не отличаться от температуры в стакане, но пузырьки образуются и в этом случае. Палец, конечно, теплее, но не настолько, чтобы это имело такой эффект. Стакан открыт, значит давление в нем равно атмосферному (мы ведь не говорим о стакане глубиной пару метров), независимо от того, вносим мы посторонний предмет или нет. Дело совсем в другом. В том, что когда жидкость попала в стакан, в ней установилось метастабильное достаточно устойчивое состояние. Именно поэтому через некоторое время после того, как жидкость налили в стакан, пена и пузырьки исчезли. То количество газа, которое должно было выделиться из жидкости, выделилось. Если мы теперь измерим концентрацию газа в стакане, окажется, что она все еще очень высока. наш раствор насыщен или даже пересыщен. Термодинамически из раствора должно выделиться еще некоторое количество газа. Но кинетически его выделение затруднено из-за потенциальных барьеров. Внесение в раствор постороннего предмета помогает системе преодолеть потенциальный барьер. Как и почему - чуть позже.
Между прочим, в точности то же самое происходит, когда мы бросаем кусочек сахара в очень насыщенный сахарный сироп: мгновенно начинается рост кристалла, то есть выделение из раствора некоторого количества растворенного сахара. Еще очень похожий процесс мы наблюдаем, когда кипятим воду в чайнике или кастрюльке. Вначале система как будто набирается сил, чтобы преодолеть какое-то препятствие. Из чайника интенсивно идет пар, он шумит, но пузырей не видно. Потом вдруг образуются первые пузыри - и в одно мгновение стихает шум, и процесс кипения становится совсем другим.
Мы обобщим все эти наблюдения таким образом: выделение из раствора газа или осадка - это образование новой фазы. По пока еще невыясненной нами причине образование новой фазы имеет потенциальный барьер. Вот в природе этого барьера нам и предстоит разобраться в продолжении этого раздела.
- Subscribe
- Блог пользователя lugovsa
- Войдите, чтобы оставлять комментарии
Новые записи в блогах
- Как добиться популярности в TikTok
- Как производятся памятники из гранита
- Фильм «Джон Картер» - жизнь на Марсе есть
- Театр-Музей Сальвадора Дали и замок Пуболь
- Игровой автомат Golden Games в казино Эльдорадо
- SlotV с небывалой отдачей
- Шоп туры в Италию
- Пляжный отдых в Греции и Испании
- Заработок без вложений - как поднять денег на играх.
- ТОП достопримечательностей Берлина



Новые комментарии