Фаза - микроскопическое определение. Минимальный размер фазы
*
Мы уже выяснили, что поверхностные атомы существенно отличаются от внутренних атомов группы. Прежде всего, они отличаются энергией, но из-за этого у них различная устойчивость, различная склонность вступать в химические реакции, различная активность в разного рода процессах. Фактически, поверхность отличаются от балка того же вещества не намного меньше, чем одно вещество отличается от другого. Попробуем оценить, какой процент от общего числа атомов составляют атомы поверхности.
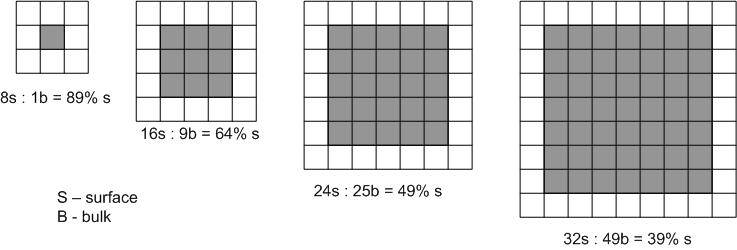
Начнем с рассмотрения очень упрощенной, но зато легко понимаемой и легко просчитываемой модели. Предположим, что мы живем в двухмерном мире, причем все атомы в этом мире квадратные. И начнем считать долю атомов поверхности в процентах от общего числа атомов с очень маленьких групп атомов. Самая маленькая группа будет состоять из одного-единственного атома, который очевидным образом будет поверхностным (поскольку он ни с какой стороны не граничит с другими атомами того же типа). То есть, для группы из одного атома доля поверхностных атомов равна 100%. Будем понемногу увеличивать группу атомов (поверхностные атомы обозначим буквой s, а внутренние - буквой b):
Легко увидеть, что с ростом числа наших "квадратных" атомов в группе доля поверхности быстро уменьшается. Для группы из 100 (квадрат 10х10) атомов поверхностных будет уже только 36%, для группы из 900 (30х30) атомов - 13%, для 10 000 (100х100) атомов - 4%, для миллиона атомов (1000х1000) - 0.4%.
Если мы перейдем от двухмерного мира к более привычному трехмерному, но сохраним "квадратность" атомов и их групп, то уменьшение доли поверхностных атомов будет происходить похожими темпами (чуточку медленнее, чем для двух измерений):
| длина ребра кубика | количество атомов в кубике | количество поверхностных атомов | доля поверхностных атомов |
| 1 | 1 | 1 | 100% |
| 10 | 1000 | 488 | 48.8% |
| 100 | 1 000 000 | 58 808 | 5.9% |
| 1000 | 1 000 000 000 | 5 988 008 | 0.6% |
Тенденция вполне очевидна. Она не сильно изменится, если мы заменим кубические атомы сферическими (или любой другой формы) или изменим форму группы. В любом случае,
Чем больше размер группы атомов, тем меньше доля поверхности.
Очевидно, начиная с какого-то числа атомов доля поверхности становится пренебрежимо малой. Обычно в физике и химии принято пренебрегать величиной, которая составляет менее 1% от другой величины. (Разумеется, этот критерий совершенно произволен, вполне можно было бы установить какой-нибудь другой "порог пренебрежимости". Однако на практике 1% - это совсем неплохой критерий, многократно проверенный и удобный. Согласитесь, что ошибка в 10 граммов при взвешивании 1 кг колбасы или ошибка в 1 см при покупке 1 м ткани или проволоки - это вполне допустимая нормальная погрешность.) "Порог" в 1% поверхностных атомов группа проходит при общем количестве атомов порядка десяти - ста миллионов. Я не привожу точную цифру, потому что наш анализ изначально носит приблизительный характер. Скажем, для кубических атомов в кубической группе общее количество атомов будет аж 214 миллионов. Но для других форм группы и других форм атомов цифры будут сильно отличаться.
Итак, когда группа будет насчитывать 107 - 108 атомов, доля поверхностных атомов станет пренебрежимо малой. Следовательно, для большинства случаев свойствами поверхности вещества можно пренебречь, если вещество собрано в группу, насчитывающую не менее десяти - ста миллионов атомов.
Что такое сто миллионов атомов? Кусок железа массой 56 грамм (примерный вес однодюймовой гайки, которой закручивают ответвление водопроводной трубы) содержит 6·1023 атомов. Еле заметная глазу опилка толщиной 0.1 мм, длиной 0.5 мм и весом примерно 0.03 мг содержит порядка 3·1017атомов. Фактически, любая, даже самая крохотная частица макромира содержит намного больше атомов, чем то количество, при котором нам нужно учитывать особые свойства поверхности.
Теперь нам осталось сделать последний в этой части шаг и сказать, что
Группа атомов, имеющая достаточные размеры, чтобы можно было пренебречь отличиями поверхностных атомов от внутренних, называется фазой.
Итак, для того, чтобы группа атомов имела право называться фазой, она должна содержать не менее 107 - 108 атомов. Давайте прикинем ее размер, внось воспользовавшись моделью "кубических атомов". Если известно, что размеры одного атома находятся в интервале 0.03 - 0.7 нм, а ребро "кубической фазы" должно содержать, как минимум, порядка 600 атомов (что даст чуть больше 2·108 атомов в фазе), то длина этой фазы составит 18 - 420 нм. Удивительно, как точно мы попали как раз в тот интервал, по которому проходит граница микромира. Учитывая, что наши подсчеты носят приблизительный характер, и учитывая, что на самом деле переход от макромира к микромиру происходит не скачком, а плавно, можно показать еще одну важную особенность наносостояния:
При уменьшении размеров частиц вещества до нанометрических понятие фазы теряет смысл.
При этом более крупные наночастицы еще можно считать фазой, средние наночастицы - это некоторое промежуточное состояние между фазой и "нефазой", а мелкие наночастицы уже не составляют фазу.
- Subscribe
- Блог пользователя lugovsa
- Войдите, чтобы оставлять комментарии
Новые записи в блогах
- Как добиться популярности в TikTok
- Как производятся памятники из гранита
- Фильм «Джон Картер» - жизнь на Марсе есть
- Театр-Музей Сальвадора Дали и замок Пуболь
- Игровой автомат Golden Games в казино Эльдорадо
- SlotV с небывалой отдачей
- Шоп туры в Италию
- Пляжный отдых в Греции и Испании
- Заработок без вложений - как поднять денег на играх.
- ТОП достопримечательностей Берлина



Новые комментарии